Entrez un mot ou une phrase dans n'importe quelle langue 👆
Langue:
Traduction et analyse des mots par intelligence artificielle
Sur cette page, vous pouvez obtenir une analyse détaillée d'un mot ou d'une phrase, réalisée à l'aide de la meilleure technologie d'intelligence artificielle à ce jour:
- comment le mot est utilisé
- fréquence d'utilisation
- il est utilisé plus souvent dans le discours oral ou écrit
- options de traduction de mots
- exemples d'utilisation (plusieurs phrases avec traduction)
- étymologie
Qu'est-ce (qui) est Радиоактивность - définition
ПРОЦЕСС РАДИОАКТИВНОГО РАСПАДА: СПОНТАННОЕ ИЗМЕНЕНИЕ СОСТАВА НЕСТАБИЛЬНЫХ АТОМНЫХ ЯДЕР
Радиоактивность; Ядерный распад; Лучи Беккереля; Радиоактивное излучение; Radioactive decay; Искусственная радиоактивность
Радиоактивность
(от лат. radio - излучаю, radius - луч и activus - действенный)
 .
.
 .
.
 (
( ).
).
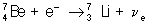 (
( ).
).
самопроизвольное (спонтанное) превращение неустойчивого изотопа химического элемента в другой изотоп (обычно - изотоп другого элемента). Сущность явления Р. состоит в самопроизвольном изменении состава атомного ядра, находящегося в основном состоянии либо в возбуждённом долгоживущем (метастабильном) состоянии. Такие превращения сопровождаются испусканием ядрами элементарных частиц либо других ядер, например ядер 2He (α-частиц). Все известные типы радиоактивных превращений являются следствием фундаментальных взаимодействий микромира: сильных взаимодействий (См. Сильные взаимодействия) (ядерные силы) или слабых взаимодействий (См. Слабые взаимодействия). Первые ответственны за превращения, сопровождающиеся испусканием ядерных частиц, например α-частиц, протонов или осколков деления ядер: вторые проявляются в β-распаде ядер. Электромагнитные взаимодействия ответственны за квантовые переходы между различными состояниями одного и того же ядра, которые сопровождаются испусканием гамма-излучения (См. Гамма-излучение). Эти переходы не связаны с изменениями состава ядер и поэтому, согласно современной классификации, не принадлежат к числу радиоактивных превращений. Понятие "Р." распространяют также на β-распад Нейтронов.
Р. следует отличать от превращений составных ядер, образующихся в процессе ядерных реакций (См. Ядерные реакции) в результате поглощения ядром-мишенью падающей на него ядерной частицы. Время жизни такого ядра значительно превышает время пролёта падающей частицей расстояния порядка ядерных размеров (10-21-10-22 сек) и может достигать 10-13-10-14 сек. Поэтому условно нижней границей продолжительности жизни радиоактивных ядер считается время порядка 10-12 сек.
Типы радиоактивных превращений. Все известные виды Р. можно разделить на две группы: элементарные (одноступенчатые) превращения и сложные (двухступенчатые). К первым относятся: 1) Альфа-распад, 2) все варианты Бета-распада (с испусканием электрона, позитрона или с захватом орбитального электрона), 3) спонтанное деление ядер, 4) протонная Р., 5) двупротонная Р. 116) двунейтронная Р. В случае β-распада достаточно большое время жизни ядер обеспечивается природой слабых взаимодействий. Все остальные виды элементарных радиоактивных процессов обусловлены ядерными силами. Замедление таких процессов до промежутков времени ≥ 10-12 сек вызвано наличием потенциальных барьеров (См. Потенциальный барьер) (кулоновского и центробежного), которые затрудняют вылет ядер или ядерных частиц.
К двухступенчатым радиоактивным превращениям относят процессы испускания т. н. запаздывающих частиц: протонов, нейтронов, α-частиц, ядер трития (См. Тритий) и 3He, а также запаздывающее спонтанное деление. Запаздывающие процессы включают в себя β-распад как предварительную стадию, обеспечивающую задержку последующего, мгновенного испускания ядерных частиц. Т. о., в случае двухступенчатых процессов критерий Р. относительно времени жизни удовлетворяется только для первой стадии, благодаря её осуществлению за счёт слабых взаимодействий.
Историческая справка. Открытие Р. датировано 1896, когда А. Беккерель обнаружил испускание ураном неизвестного вида проникающего излучения, названного им радиоактивным. Вскоре была обнаружена Р. тория, а в 1898 супруги М. Кюри и П. Кюри открыли два новых радиоактивных элемента - Полоний и Радий. Работами Э. Резерфорда и упомянутых учёных было установлено наличие 3 видов излучения радиоактивных элементов - α-, β- и γ-лучей - и выявлена их природа. В 1903 Резерфорд и Ф. Содди выяснили, что испускание α-лучей сопровождается превращением химических элементов, например превращением радия в Радон. В 1913 К. Фаянс (Германия) и Содди независимо сформулировали правило смещения, характеризующее перемещение изотопа в периодической системе элементов (См. Периодическая система элементов) при различных радиоактивных превращениях.
В 1934 супругами И. Жолио-Кюри и Ф. Жолио-Кюри была открыта искусственная Р., которая впоследствии приобрела особенно важное значение. Из общего числа (около 2000) известных ныне радиоактивных изотопов лишь около 300 природные, а остальные получены искусственно, в результате ядерных реакций. Между искусственной и естественной Р. нет принципиального различия. В результате изучения искусственной Р. были открыты новые варианты β-распада - испускание позитронов (И. и Ф. Жолио-Кюри, 1934) и Электронный захват (Л. Альварес, 1938), предсказанный первоначально Х. Юкавой (См. Юкава) и С. Сакатой (Япония, 1935). Впоследствии были обнаружены сложные, включающие β-распад, превращения, в том числе испускание запаздывающих нейтронов (Дж. Даннинг с сотрудниками, США, 1939), запаздывающих протонов (В. А. Карнаухов с сотрудниками, СССР, 1962), запаздывающее деление ядер (Г. Н. Флёров с сотрудниками, 1966-71). Предсказана возможность существования запаздывающих излучателей ядер 3H и 3He (Э. Е. Берлович, Ю. Н. Новиков, СССР, 1969). В 1935 И. В. Курчатов с сотрудниками открыли явление изомерии (существование долгоживущих возбуждённых состояний) у искусственно радиоактивных ядер (см. Изомерия атомных ядер). В 1940 К. А. Петржак и Флёров открыли спонтанное деление ядер. Существование протонной активности предполагалось ещё Резерфордом. Перспективы обнаружения 4-го типа Р. и основные его характеристики изучались Б. С. Джелеповым (1951, СССР) и др. Экспериментально элементарный акт радиоактивного распада с испусканием протонов (из изомерного состояния) впервые наблюдали Дж. Черны с сотрудниками (США, 1970). В 1960 В. И. Гольданский предсказал существование двупротонной Р., а в 1971 Гольданский и Л. К. Пекер (СССР) - двунейтронный радиоактивный распад ядер (только из изомерного состояния).
Закон радиоактивного распада. Единицы радиоактивности. Для процессов радиоактивного распада ядер (и элементарных частиц) характерен экспоненциальный закон уменьшения во времени среднего числа активных ядер. Этот закон отражает независимость распада отдельного ядра от остальных ядер. Обычно продолжительность жизни радиоактивных ядер характеризуют периодом полураспада - промежутком времени T1/2 на протяжении которого число радиоактивных ядер уменьшается в среднем вдвое. Поскольку продолжительность жизни отдельного ядра оказывается неопределённой, экспоненциальный закон распада выполняется лишь в среднем, причём тем точнее, чем больше полное число радиоактивных ядер.
Основная единица радиоактивности - Кюри, первоначально определялась как активность 1 г Ra. В дальнейшем под 1 кюри стали понимать активность радиоактивного препарата, в котором происходит 3,7․1010 распадов в сек. Широко используются дробные единицы (например, мкюри, мккюри) и кратные единицы (ккюри, Мкюри). Другая единица радиоактивности - Резерфорд, равна 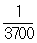 кюри, что соответствует 106 в сек.
кюри, что соответствует 106 в сек.
Альфа-распад представляет собой самопроизвольное превращение ядер, сопровождающееся испусканием двух протонов и двух нейтронов, образующих ядро  . В результате α-распада заряд ядра уменьшается на 2, а массовое число на 4 единицы, например:
. В результате α-распада заряд ядра уменьшается на 2, а массовое число на 4 единицы, например:
Кинетическая энергия вылетающей α-частицы определяется массами исходного и конечного ядер и α-частицы. Если конечное ядро образуется в возбуждённом состоянии, эта энергия несколько уменьшается, и, напротив, возрастает, если распадается возбуждённое ядро (в последнем случае испускаются т. н. длиннопробежные α-частицы). Энергетический спектр α-частиц дискретный. Период полураспада α-радиоактивных ядер экспоненциально зависит от энергии вылетающих α-частиц (см. Гейгера - Неттолла закон). Теория α-распада, основанная на квантовомеханическом описании проникновения через потенциальный барьер, была развита в 1928 Г. Гамовым и независимо - англ. физиками Р. Гёрни и Э. Коцдоном.
Известно более 200 α-активных ядер, расположенных в основном в конце периодической системы, за Pb, которым заканчивается заполнение протонной ядерной оболочки с Z = 82 (см. Ядерные модели). Известно также около 20 α-радиоактивных изотопов редкоземельных элементов. Здесь α-распад наиболее характерен для ядер с числом нейтронов N = 84, которые при испускании α-частиц превращаются в ядра с заполненной нейтронной ядерной оболочкой (N = 82). Времена жизни α-активных ядер колеблются в широких пределах: от 3․10-7сек (для 212Po) до (2-5)․1015 лет (природные изотопы 142Ce, 144Nd, 174Hf). Энергия наблюдаемого α-распада лежит в пределах 4-9 Мэв (за исключением длиннопробежных α-частиц) для всех тяжёлых ядер и 2-4,5 Мэв для редкоземельных элементов.
Бета-распад представляет собой самопроизвольное взаимное превращение протонов и нейтронов, происходящее внутри ядра и сопровождающееся испусканием или поглощением электронов (е-) или позитронов (е+), нейтрино (νe) или антинейтрино (v̅e).
1) Электронный β- -распад: n → р + е- + v̅e; например,
2) Позитронный β+-распад: p → 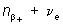 ; например,
; например,
3) Электронный захват: p →  ; например,
; например,
Захват электронов происходит с одной из атомных оболочек, чаще всего с ближайшей к ядру К-оболочки (К-захват), реже - со следующих, L- и М-оболочек (L- и М-захваты), β--распад характерен для нейтроноизбыточных ядер, в которых число нейтронов больше, чем в устойчивых ядрах (а для ядер с Z > 83, если число нейтронов больше, чем в β-стабильных ядрах, испытывающих только α-распад). β+-распад и электронный захват свойственны нейтронодефицитным ядрам, более лёгким, чем устойчивые или β-стабильные ядра. Энергия при β-распаде распределяется между 3 частицами: электроном или позитроном, антинейтрино или нейтрино и конечным ядром; поэтому спектр β-частиц сплошной. Бета-радиоактивные изотопы встречаются у всех элементов периодической системы. Особенностью электронного захвата является слабая зависимость его скорости от химического состояния превращающихся атомов. Ядро захватывает электрон с какой-либо из электронных оболочек атома, а вероятность подобного захвата определяется строением не только внутренней оболочки, отдающей ядру электрон, но и (в меньшей степени) более отдалённых оболочек, в том числе и валентных. Изменение заряда ядра при β-распаде влечёт за собой последующую перестройку ("встряску") электронных атомных оболочек, возбуждение, ионизацию атомов и молекул, разрыв химических связей. Химические последствия β-распада (и в меньшей степени др. радиоактивных превращений) являются предметом многочисленных исследований (см. Радиохимия).
Спонтанное деление представляет собой самопроизвольный распад тяжёлых ядер на два (реже - 3 или 4) осколка - ядра элементов середины периодической системы. Спонтанное деление и α-распад ограничивают возможности получения новых трансурановых элементов (См. Трансурановые элементы).
Протонная и двупротонная Р. должны представлять собой самопроизвольный распад нейтронодефицитных ядер с испусканием 1 или одновременно 2 протонов, проникающих сквозь кулоновский барьер путём туннельного эффекта (См. Туннельный эффект). Причиной возможности двупротонной Р. служит спаривание в ядре протонов с противоположно направленными спинами, сопровождающееся выделением энергии около 2 Мэв. В результате этого испускание из ядра одновременно пары протонов может потребовать затраты меньшей энергии, чем отрыв одного из них от другого, а в ряде случаев может идти даже с выделением энергии (причём за время > 10-12 сек), тогда как испускание одиночного протона потребовало бы, наоборот, затраты энергии.
Трудности наблюдения протонной и двупротонной Р. обусловлены как коротким (по сравнению с др. типами Р.) временем жизни р- и 2р-радиоактивных ядер, так и тем, что эти ядра характеризуются очень сильным дефицитом нейтронов и потому могут быть получены в ядерных реакциях, сопровождающихся вылетом большого числа нейтронов и поэтому маловероятных. Протонную Р. до сих пор удалось наблюдать (см. выше) лишь при распаде не основного, а возбуждённого (изомерного) состояния ядра 53MCo. Двупротонная Р. так же, как и двунейтронный распад, экспериментально пока не обнаружены.
Гамма-лучи. Ядерные изомеры. Испускание γ-квантов сопровождает Р. в тех случаях, когда "дочерние" ядра образуются в возбуждённых состояниях. Время жизни ядер в таких возбуждённых состояниях определяется свойствами (Спином, Чётностью, энергией) данного уровня и нижележащих уровней, на которые могут происходить переходы с испусканием γ-квантов. Длительность γ-переходов резко возрастает с уменьшением их энергии и с увеличением разности моментов исходного и конечного состояний ядра. В ряде случаев эта длительность существенно превышает 10-10-10-9 сек, т. е. наряду с основным состоянием данного стабильного или радиоактивного ядра может относительно долго (иногда годы) существовать его метастабильное возбуждённое (изомерное) состояние. Для многих ядерных изомеров наблюдается явление внутренней электронной конверсии: возбуждённое ядро, не излучая γ-квантов, передаёт свою избыточную энергию электронным оболочкам, вследствие чего один из электронов вылетает из атома. После внутренней конверсии возникает вторичное излучение рентгеновского и оптического диапазона вследствие заполнения одним из электронов освободившегося места и последующих переходов. Участие электронных оболочек в конверсионных переходах приводит к тому, что время жизни соответствующих изомеров зависит (хотя и очень слабо) от химического состояния превращающихся атомов.
Известны изомеры, для которых преобладает не γ-излучение с образованием др. состояния того же изотопа, но распад по какому-либо из основных типов Р. Так, изомер  (T1/2 = 3,7 ч) испытывает, как и основной изотоп
(T1/2 = 3,7 ч) испытывает, как и основной изотоп  , β-распад; изомер
, β-распад; изомер  (T1/2 = 45 сек), как и основной изотоп
(T1/2 = 45 сек), как и основной изотоп 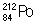 , - α-распад; изомер
, - α-распад; изомер 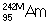 (T1/2 = 14 мсек) - спонтанное деление.
(T1/2 = 14 мсек) - спонтанное деление.
Радиоактивные ряды (семейства). Во многих случаях продукты радиоактивного распада сами оказываются радиоактивными и тогда образованию стабильного изотопа предшествует цепочка из нескольких актов радиоактивного распада. Примерами таких цепочек являются радиоактивные ряды природных изотопов тяжёлых элементов, которые начинаются нуклидами 238U, 235U, 232Th и заканчиваются стабильными изотопами свинца 206РЬ, 207РЬ, 208РЬ. Многие радиоактивные изотопы могут распадаться по 2 или нескольким из перечисленных выше основных типов Р. В результате такой конкуренции разных путей распада возникают разветвления радиоактивных превращений. Для природных радиоактивных изотопов характерны разветвления, обусловленные возможностью α- и β--распадов. Для изотопов трансурановых элементов наиболее распространены разветвления, связанные с конкуренцией α- (реже β--) распадов и спонтанного деления. У нейтронодефицитных ядер зачастую наблюдается конкуренция β+-распада и электронного захвата. Для многих изотопов с нечётными Z и чётными А оказываются энергетически возможными два противоположных варианта β-распада: β--распад и электронный захват или β-- и β+-распады.
Заключение. Открытие Р. оказало огромное влияние на развитие науки и техники. Оно ознаменовало начало эпохи интенсивного изучения свойств и структуры вещества. Новые перспективы, возникшие в энергетике, промышленности и многих др. областях человеческой деятельности благодаря овладению ядерной энергией, были вызваны к жизни обнаружением способности химических элементов к самопроизвольным превращениям. За работы, связанные с исследованием и применением Р., было присуждено более 10 Нобелевских премий по физике и химии, в том числе А. Беккерелю, П. и М. Кюри, Э. Ферми, Э. Резерфорду, Ф. и И. Жолио-Кюри, Д. Хевеши, О. Гану, Э. Макмиллану и Г. Сиборгу, У. Либби и др.
Лит.: Кюри М., Радиоактивность, пер. с франц., 2 изд., М. - Л., 1960; Мурин А. Н., Введение в радиоактивность, Л., 1955; Давыдов А. С., Теория атомного ядра, М., 1958; Гайсинский М. Н., Ядерная химия и ее приложения, пер. с франц., М., 1961; Экспериментальная ядерная физика, под ред. Э. Сегре, пер. с англ., т. 3, М., 1961; Учение о радиоактивности. История и современность, М., 1973.
В. И. Гольданский, Е. М. Лейкин.
радиоактивность
РАДИОАКТИВНОСТЬ
самопроизвольное превращение атомов одного элемента в атомы других элементов, сопровождающееся испусканием частиц и жесткого электромагнитного излучения.
Историческая справка. Беккерель. Весной 1896 французский физик А.Беккерель сделал ряд сообщений об обнаружении им нового вида излучения (впоследствии названном радиоактивным), которое испускается солями урана. Подобно открытым за несколько месяцев до этого рентгеновским лучам, оно обладало проникающей способностью, засвечивало экранированную черной бумагой фотопластинку и ионизировало окружающий воздух. Гипотеза, которая привела к открытию радиоактивности, возникла у Беккереля под влиянием исследований Рентгена. Поскольку при генерации Х-лучей наблюдалась фосфоресценция стеклянных стенок рентгеновской трубки, Беккерель предположил, что любое фосфоресцентное свечение сопровождается испусканием рентгеновского излучения. Для проверки этого предположения он поместил различные фосфоресцирующие вещества на завернутые в черную бумагу фотопластинки и получил неожиданный результат: засвеченной оказалась единственная пластинка, с которой соприкасался кристалл соли урана. Многочисленные контрольные опыты показали, что причиной засветки явилась не фосфоресценция, а именно уран, в каком бы химическом соединении он ни находился. Свойство радиоактивного излучения вызывать ионизацию воздуха позволило наряду с фотографическим методом регистрации применять более удобный электрический метод, что значительно ускорило процесс исследований.
Кюри. Пользуясь электрическим методом, Г.Шмидт и М.Кюри в 1898 обнаружили радиоактивность элемента тория. В следующем году Дебьерн открыл радиоактивный элемент актиний. Начатый супругами П. и М.Кюри систематический поиск новых радиоактивных веществ и изучение свойств их излучения подтвердили догадку Беккереля о том, что радиоактивность урановых соединений пропорциональна числу содержащихся в них атомов урана. Среди обследованных минералов эту закономерность нарушала лишь урановая смоляная руда (уранинит), которая оказалась в четыре раза активнее, чем соответствующее количество чистого урана. Кюри сделали вывод о том, что в уранините должен содержаться неизвестный высокоактивный элемент. Проведя тщательное химическое разделение уранинита на составляющие компоненты, они открыли радий, по химическим свойствам сходный с барием, и полоний, который выделялся вместе с висмутом.
Резерфорд. В дальнейших исследованиях радиоактивности ведущая роль принадлежала Э.Резерфорду. Сосредоточив внимание на изучении этого явления, он установил природу радиоактивных превращений и сопутствующего им излучения.
Излучение радиоактивных веществ. Естественные радиоактивные элементы испускают три вида излучений: альфа, бета и гамма. В 1899 Резерфорд идентифицировал альфа- и бета-излучение; спустя год П.Вийар открыл гамма-излучение.
Альфа-излучение. В воздухе при атмосферном давлении альфа-излучение преодолевает лишь небольшое расстояние, как правило, от 2,5 до 7,5 см. В условиях вакуума электрическое и магнитное поля заметно отклоняют его от первоначальной траектории. Направление и величина отклонений указывают на то, что альфа-излучение - это поток положительно заряженных частиц, для которых отношение заряда к массе (e/m) в точности соответствует дважды ионизированному атому гелия (He++). Эти данные и результаты спектроскопического исследования собранных альфа-частиц позволили Резерфорду сделать вывод о том, что они являются ядрами атома гелия.
Бета-излучение. Это излучение обладает большей проникающей способностью, чем альфа-излучение. Как и альфа-излучение, оно отклоняется в магнитном и электрическом полях, но в противоположную сторону и на большее расстояние. Это указывает на то, что бета-излучение является потоком отрицательно заряженных частиц малой массы. По отношению e/m Резерфорд идентифицировал бета-частицы как обычные электроны.
Гамма-излучение. Гамма-излучение проникает в вещество гораздо глубже, чем альфа- и бета-излучения. Оно не отклоняется в магнитном поле и, следовательно, не имеет электрического заряда. Гамма-лучи были идентифицированы как жесткое (т.е. имеющее очень высокую энергию) электромагнитное излучение. Разделение радиоактивного излучения в магнитном поле на альфа-, бета- и гамма-лучи схематично показано на рисунке.
Теория радиоактивного распада. В процессе эмиссии радиоактивного излучения вещество претерпевает ряд изменений. Так, например, излучение радия сопровождается выделением газообразного радона ("эманацией"). В свою очередь радон, распадаясь, оставляет радиоактивные отложения на стенках содержащего его сосуда. Собранная при распаде радия эманация теряет половину исходной активности примерно за 4 сут. Эти и другие не поддававшиеся интерпретации экспериментальные факты удалось объяснить с помощью теории радиоактивного распада атомов, предложенной Резерфордом и Содди в 1903, а также правила смещения, сформулированного в 1913 А.Расселом и независимо от него Фаянсом и Содди. Суть теории Резерфорда и Содди состоит в том, что в результате радиоактивного распада происходит превращение одного химического элемента в другой.
Правило смещения. Правило смещения точно указывает, какие именно превращения претерпевает химический элемент, испуская радиоактивное излучение.
Эмиссия альфа- и бета-частиц. Правило смещения можно пояснить с помощью ядерной модели атома, предложенной Резерфордом в 1911. Согласно этой модели, в центре атома находится положительно заряженное ядро, в котором сосредоточена основная часть массы атома. Вокруг ядра вращаются электроны, заряд которых компенсирует положительный заряд ядра. Каждому атому приписывается свой атомный номер Z, соответствующий его порядковому номеру в периодической таблице Менделеева и численно равный заряду ядра, выраженному в единицах заряда электрона. Альфа-частица имеет Z = 2 и массовое число (округленный атомный вес) A = 4. Если неустойчивое ядро испускает бета-частицу, то его Z увеличивается на единицу, а массовое число не изменяется. Следовательно, радиоактивный атом превращается в следующий по порядку атом таблицы Менделеева. При эмиссии альфа-частицы Z и A вновь образованного ядра уменьшаются на 2 и 4 единицы соответственно, а дочерний атом, испытав соответствующее изотопическое превращение, "смещается" в таблице Менделеева влево от родительского элемента.
Гамма-излучение. Орбитальные электроны, получив избыток энергии, могут переходить на более высокие энергетические уровни. Возвращаясь в основное (нормальное) состояние, они отдают избыток энергии в виде света или рентгеновского излучения. Ядра атомов, обладающие избыточной энергией, также могут переходить в возбужденное состояние. Подобное возбуждение часто испытывают ядра, образующиеся в процессе радиоактивных превращений. Переходя в основное состояние, они излучают избыток энергии в виде гамма-квантов.
Особый интерес представляет вариант распада, когда радиоактивное ядро имеет большое время жизни возбужденного состояния. В этом случае у находящихся в разных энергетических состояниях одинаковых ядер (с одинаковыми значениями Z и A) наблюдаются однотипные радиоактивные распады, но происходят они с разными скоростями, поскольку одни ядра распадаются из возбужденного, а другие из основного состояния. Это явление получило название ядерной изомерии, а возбужденное и нормальное ядра называются изомерами.
Радиоактивные ряды. Правило смещения позволило проследить превращения естественных радиоактивных элементов и выстроить из них три генеалогических дерева, родоначальниками которых являются уран-238, уран-235 и торий-232. Каждое семейство начинается с чрезвычайно долгоживущего радиоактивного элемента. Урановое семейство, например, возглавляет уран с массовым числом 238 и периодом полураспада 4,5?109 лет (в табл. 1 в соответствии с первоначальным названием обозначен как уран I).
Период полураспада. Важнейшей характеристикой радиоактивного атома является его время жизни. Согласно закону радиоактивного распада, вероятность того, что за данный промежуток времени произойдет распад одного атома, есть величина постоянная. Следовательно, число ежесекундно происходящих распадов пропорционально количеству имеющихся атомов, а закон, описывающий процесс распада, имеет экспоненциальный характер. Если за время Т распадается половина исходного количества радиоактивных атомов, то половина оставшихся атомов распадется в течение следующего промежутка времени той же длительности. Время Т называется периодом полураспада радиоактивного элемента. Для различных элементов период полураспада составляет от десятков миллиардов лет до миллионных долей секунды и менее.
Семейство урана. На элементах семейства урана можно проследить большинство обсуждавшихся выше свойств радиоактивных превращений. Так, например, у третьего члена семейства наблюдается ядерная изомерия. Уран X2, испуская бета-частицы, превращается в уран II (T = 1,14 мин). Это соответствует бета-распаду возбужденного состояния протактиния-234. Однако в 0,12% случаев возбужденный протактиний-234 (уран X2) излучает гамма-квант и переходит в основное состояние (уран Z). Бета-распад урана Z, также приводящий к образованию урана II, происходит за 6,7 ч.
Радий С интересен тем, что может распадаться двумя путями: испуская либо альфа-, либо бета-частицу. Эти процессы конкурируют между собой, но в 99,96% случаев происходит бета-распад с образованием радия С?. В 0,04% случаев радий С испускает альфа-частицу и превращается в радий С?. (RaC??). В свою очередь RaC. и RaC?. путем эмиссии альфа- и бета-частиц соответственно превращаются в радий D.
Изотопы. Среди членов уранового семейства встречаются такие, атомы которых имеют одинаковый атомный номер (одинаковый заряд ядер) и разные массовые числа. Они идентичны по химическим свойствам, но различаются по характеру радиоактивности. Например, радий B, радий D и радий G, имеющие одинаковый со свинцом атомный номер 82, подобны свинцу по химическому поведению. Очевидно, что химические свойства не зависят от массового числа; они определяются строением электронных оболочек атома (следовательно, и Z). С другой стороны, массовое число имеет решающее значение для ядерной стабильности радиоактивных свойств атома. Атомы с одинаковым атомным номером и разными массовыми числами называются изотопами. Изотопы радиоактивных элементов были открыты Ф.Содди в 1913, но вскоре Ф.Астон с помощью масс-спектроскопии доказал, что изотопы имеются и у многих стабильных элементов.
Другие естественные радиоактивные элементы. Все элементы, расположенные в периодической таблице за висмутом (т.е. с Z 83), являются радиоактивными. Подобно урану-238, долгоживущие уран-235 и торий-232 возглавляют соответственно актиниевое и ториевое радиоактивные семейства. В естественных условиях встречаются уран, торий и их дочерние радиоактивные продукты. Это обусловлено тем, что периоды полураспада у родоначальников семейств сравнимы с возрастом Земли, и они пока еще не распались полностью. Химические элементы с атомным номером 92 получены в лабораториях в результате ядерных реакций и обнаружены среди продуктов термоядерных взрывов, причем все они оказались радиоактивными.
Среди более легких элементов лишь немногие обладают естественной радиоактивностью. Периоды полураспада у них столь велики, что они до сих пор существуют на Земле в заметных количествах. Радиоактивный калий-40, испуская бета-частицы, превращается в стабильный кальций-40 (T 109 лет). Однако он может распадаться и путем захвата электрона, превращаясь в аргон-40. Бета-активный рубидий-87, распадаясь (T 6?1010 лет), переходит в стабильный стронций-87. Встречающийся в природе самарий-152 - единственный более легкий, чем висмут, радиоактивный элемент, испускающий альфа-частицы. Его период полураспада - 1012 лет.
У элементов с атомными номерами 43, 61, 85 и 87 нет ни стабильных изотопов, ни долгоживущих предшественников, поэтому на Земле они не обнаружены. У самого долгоживущего изотопа технеция (Z = 43) период полураспада - порядка 300 000 лет, что значительно меньше предполагаемого возраста Вселенной. Однако значительное количество технеция обнаружено в составе звезд спектрального класса S. Этот факт интерпретируется как явное доказательство того, что в них сравнительно недавно происходили активные эволюционные процессы.
Искусственная радиоактивность. Бомбардируя альфа-частицами атомы газообразного азота, Э.Резерфорд и Дж.Чедвик в 1919 впервые осуществили ядерную реакцию, вызвав превращение азота в кислород. С появлением ускорителей заряженных частиц фронт работ по изучению ядерных реакций значительно расширился. В 1934 Фредерик и Ирен Жолио-Кюри открыли явление искусственной радиоактивности и позитронный тип распада. Они обнаружили, что облученные альфа-частицами бор, магний и алюминий превращаются в радиоактивные изотопы других элементов, распад которых сопровождается испусканием позитрона (e+). Так, например, при бомбардировке альфа-частицами алюминия образуется радиоактивный фосфор-30, который, распадаясь (T = 2,5 мин), испускает e+ и превращается в стабильный кремний-30. Позитрон, открытый в 1932 К.Андерсоном в создаваемом космическими лучами вторичном излучении, представляет собой частицу, по массе и величине заряда идентичную электрону, но имеющую положительный электрический заряд (античастица электрона). При испускании позитрона ядром радиоактивного атома порядковый номер атома уменьшается на единицу, а массовое число остается без изменений.
Электронный захват. Захват ядром одного из орбитальных электронов эквивалентен испусканию позитрона: массовое число атома при этом не изменяется, а заряд ядра уменьшается на единицу. Электроны K и L оболочек находятся так близко к ядру, что в некоторых случаях захват электрона, как механизм радиоактивного распада, начинает конкурировать с испусканием позитрона. Поскольку для захвата электрона требуется меньше энергии, чем для эквивалентного позитронного распада, то иногда, как, например, в случае бериллия-7 (см. табл. 2), энергетически возможен только электронный захват.
Характеристики самых легких стабильных и радиоактивных атомов представлены в табл. 2, где Z - атомный номер, А - массовое число. Приведенная в таблице атомная масса выражена в углеродных единицах. В энергетической шкале она равна 931,162 МэВ. Атомная масса характеризует стабильность атома. Если два атома имеют одинаковые массовые числа и различные атомные номера (изобары), то более тяжелый изобар будет нестабилен относительно радиоактивного распада в более легкий. Так, тритий-3 превращается в гелий-3, углерод-11 - в бор-11.
Применение радиоактивности. Медицина. Радий и другие естественные радиоизотопы широко применяются для диагностики и лучевой терапии раковых заболеваний. Использование для этой цели искусственных радиоизотопов значительно повысило эффективность лечения. Например, радиоактивный иод, введенный в организм в виде раствора иодида натрия, селективно накапливается в щитовидной железе и поэтому применяется в в клинической практике для определения нарушений функции щитовидной железы и при лечении базедовой болезни. С помощью меченого по натрию физиологического раствора измеряется скорость кровообращения и определяется проходимость кровеносных сосудов конечностей. Радиоактивный фосфор применяется для измерения объема крови и лечения эритремии.
Научные исследования. Радиоактивные метки, в микроколичествах введенные в физические или химические системы, позволяют следить за всеми происходящими в них изменениями. Например, выращивая растения в атмосфере радиоактивного диоксида углерода, химики смогли понять тонкие детали процесса образования в растениях сложных углеводов из диоксида углерода и воды.
В результате непрерывной бомбардировки земной атмосферы космическими лучами с высокой энергией находящийся в ней азот-14, захватывая нейтроны и испуская протоны, превращается в радиоактивный углерод-14. Полагая, что интенсивность бомбардировки и, следовательно, равновесное количество углерода-14 в последние тысячелетия оставались неизменными и учитывая период полураспада C-14 по его остаточной активности, можно определять возраст найденных остатков животных и растений (радиоуглеродный метод). Этим методом удалось с большой достоверностью датировать обнаруженные стоянки доисторического человека, существовавшие более 25 000 лет тому назад. См. также АТОМА СТРОЕНИЕ; КЮРИ, ПЬЕР; РАДИОУГЛЕРОДНОЕ ДАТИРОВАНИЕ.
Wikipédia
Радиоактивный распад
Радиоакти́вный распа́д (от лат. radius «луч» и āctīvus «действенный», через фр. radioactif, букв. — «радиоактивность») — спонтанное изменение состава (заряда Z, массового числа A) или внутреннего строения нестабильных атомных ядер путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов. Процесс радиоактивного распада также называют радиоакти́вностью, а соответствующие нуклиды — радиоактивными (радионуклидами). Радиоактивными называют также вещества, содержащие радиоактивные ядра.
Exemples du corpus de texte pour Радиоактивность
1. Радиоактивность в этом случае связана с нейтронами.
2. Вроде бы дополнительно проверяющему человека на радиоактивность.
3. Пользуясь этим, ученые решили придать йоду радиоактивность.
4. "У нас, говорят, радиоактивность, - рассказала мама Дениски.
5. Некоторая радиоактивность связана с побочной реакцией D + D.

